Farbigkeit hermatypischer Steinkorallen
Farberhaltung und Pigmentneubildung im Riffaquarium - Ein Fachbericht von Dipl. Biologe Jörg Kokott, Bremen

Jörg Kokott
Inhaltsübersicht:
1. Einleitung: Farbe im „Modernen Riffaquarium“
2. Pigmente in der Koralle – Zooxanthellen – Symbiose: Chemische Struktur und biologische Funktion
3. Möglichkeiten zur Optimierung der Farbigkeit im Riffaquarium
4. Zusammenfassung
1. Einleitung
Steinkorallen dominieren heute oft den Korallenbestand in modernen Riffaquarien. Das Wachstum insbesondere der kleinpolypigen Steinkorallenarten kann in diesen Aquarien sehr stark sein, was letztlich auch dazu führt, das solche aquariengewachsenen Korallen natürliche oder naturähnliche Wuchsformen zeigen. Zu den beiden Parametern „Wachstumsrate“ und „Wuchsform“ kam in den letzten Jahren ein weiterer hinzu, die „Farbigkeit“. Es ist heute mit das entscheidenste Kriterium bei der Auswahl von Korallen für das heimische Aquarium und entsprechend besteht ein großer Bedarf an bunten Steinkorallen für den Aquaristikhandel.
Bezüglich der Farbigkeit von Steinkorallen stellen sich eine Reihe von Problemen, deren Bewältigung nicht einfach ist. Der weitaus wichtigste Punkt ist hierbei der Verlust bestehender Farben, z.B.
· nach dem Import/Erwerb,
· nach Veränderungen, v.a. in der Beleuchtung,
· nach der Umsetzung einer Koralle innerhalb des Beckens
· Veränderung der Farben nach einer längeren Zeit ohne ersichtlichen Grund.
Es ist stets eine große Enttäuschung, wenn eine schön gefärbte Steinkoralle aus einem frischen Import für teures Geld käuflich erworben wird, die Kolonie aber dann nach wenigen Wochen die ursprünglich zum Kauf angeregten Farben alle verliert. Diese Beobachtungen sind beinahe alltäglich und werden dementsprechend auch in der aquaristischen Literatur beschrieben (Brockmann, 2002).
Die zentrale Fragestellung lautet also: „Wie kann der Aquarianer die Farbe von Steinkorallen beeinflussen?“
Um darauf eine Antwort zu finden, bieten sich folgende Ansatzmöglichkeiten an:
1. Welche Pigmente sind für die Färbungen verantwortlich ?
2. Welche biologischen Funktionen erfüllen die Pigmente ?
3. Welchen Einfluß hat die Beleuchtung auf die Farbigkeit ?
4. Wie ist der Einfluß der Wasserqualität (Nährstoffgehalt) zu bewerten?
2. Pigmente in Steinkorallen
Welche Pigmente findet man in zooxanthellaten Steinkorallen?
Die Korallen – Zooxanthellen – Symbiose enthält eine Reihe von Pigmenten, die man in zwei Gruppen einteilen kann.
1) Pigmente der symbiontischen Algen: zooxanthellenspezifische Pigmente
Die Zooxanthellen tropischer Korallen sind systematisch den Dinoflagellaten („Panzergeißler“) zuzuordnen. Diese Dinoflagellaten besitzen eine charakteristische Pigmentgarnitur. Dinoflagellaten sind einzellige Algen und leben als kugelige Zellen im Gewebe der Korallen.
2) Wirtsspezifische Pigmente
Die Synthese dieser Pigmente ist unabhängig von den Zooxanthellen, es sind eigens von der Koralle (Wirt) gebildete Pigmente, die letztlich v.a. die Farbigkeit der Korallen erzeugen. Diese wirtsspezifischen Pigmente sind also für den Aquarianer von großem Interesse.
2.1 Zooxanthellenspezifische Pigmente
Hier wird nur auf die für die Photosynthese wichtigen Pigmente der Zooxanthellen eingegangen. Dabei handelt es sich um die Chlorophylle
Chlorophyll a
Chlorophyll c2
Sowie um ein für die Dinoflagellaten typisches Pigmente namens Peridinin.
Chlorophylle sind flache, zu einem großen Ring verschlossene Moleküle, die ein zentrales Magnesiumatom aufweisen. Die jeweiligen Chlorophylle unterscheiden sich lediglich anhand bestimmter Atomgruppen, die an bestimmten Stellen der Ringstruktur sitzen. Auffälligster Unterschied zwischen Chl a und Chl c2 ist der lange Fettschwanz im Chl a, der bei Chl c2 fehlt (Abb. 1).
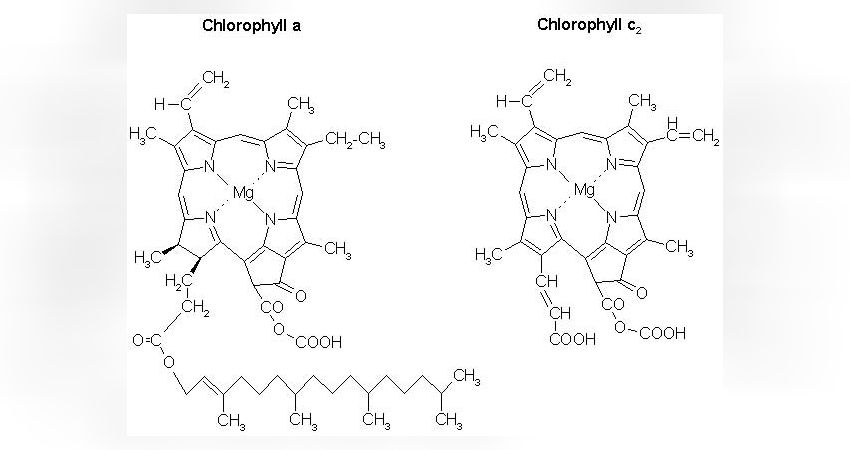
Abb. 1
Durch diese Variabilität in den Atomgruppen verändern sich die charakteristischen Absorptionseigenschaften der Moleküle.
Das Peridinin ist mit den Chlorophyllen nicht verwandt, sondern gehört zur Gruppe der Carotinoide. Strukturell zeichnen sich Carotinoide durch eine lange, lineare Molekülkette aus, die jeweils am Ende eine ringförmige Gruppe besitzen (Abb. 2)
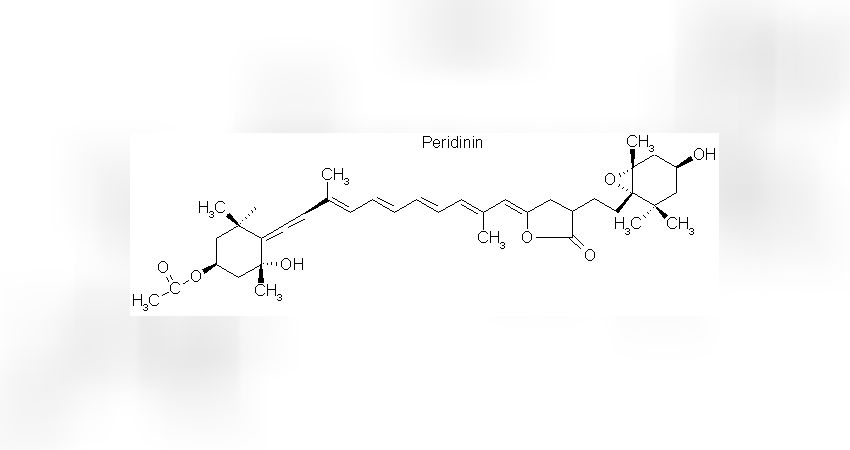
Abb. 2
Auch hier besteht eine große Variabilität in den vorhandenen Atomgruppen an den ringförmigen Molekülenden, die wiederum die Absorptionseigenschaften determinieren.
In Dinoflagellaten sind die drei Pigmente Chl a, Chl c2 und Peridinin zusammen mit Proteinen (Eiweiße) zu sogenannten Peridinin-Chlorophyll-Protein – Komplexen vereinigt. Diese PCP-Komplexe erzeugen aufgrund ihrer Absorptionseigenschaften die Braunfärbung der Dinoflagellaten, was die Grundfärbung zooxanthellater Steinkorallen darstellt (Abb. 3).

Abb. 3
Die PCP-Komplexe sind Bestandteile der Photosyntheseapparate. Es sind sog. Lichtsammlersysteme (Antennenkomplexe), die Strahlung absorbieren und dann die absorbierte Strahlungsenergie dem Photosynthesereaktionszentrum zur Verfügung stellen. Über 80% des Gesamtpigmentgehaltes findet sich in PCP-Komplexen, was die Wichtigkeit dieser speziellen Lichtsammlersysteme verdeutlicht.
2.2 Wirtsspezifische Pigmente
Während viele Farben, die wir von azooxanthellaten Weichkorallen oder Gorgonien kennen, auf Carotinoide zurückzuführen sind, die wahrscheinlich v.a. über die Nahrung aufgenommen und eingelagert werden, sind die Farben von Scheibenanemonen, Krustenanemonen oder auch Seeanemonen von sog. Chromoproteinen verursacht (Abb.4a/b).
Abb. 4 a Abb. 4 b

Auch die hermatypischen (riffbildenden) Steinkorallen synthetisieren solche Chromoproteine und erscheinen uns daher oft sehr farbig (Abb. 5) Abb. 5

Was sind Chromoproteine? Es sind solche Eiweiße, die eine farbgebende Struktur innerhalb ihres Gesamtmoleküls besitzen. Die Struktur nennt man Chromophor, oder wie im Falle von fluoreszierenden Chromoproteinen Fluorophor. Die Fähigkeit zur Synthese eines Chromoproteins ist genetisch determiniert. Eine Bildung solcher Pigmente kann also nur dann erfolgen, wenn die dafür notwendigen Informationen im Erbgut (Genom) vorhanden sind. Innerhalb der „Blumentiere“ (Anthozoa) ist die Bildung der Chromoproteine weit verbreitet. Bei den Chromoproteinen in hermatypischen Steinkorallen spricht man speziell von „Pocilloporinen“.
Arten der Gattung Pocillopora oder Seriatopora kommen oft in zwei Farbmorphen vor: einer braunen und einer pinken Farbmorphe. Das pinke Pigment wurde aus der aquaristisch sehr begehrten Koralle Pocillopora damicornis extrahiert und biochemisch untersucht. Dabei konnte u.a. festgestellt werden, daß das Pigment bei einer Strahlungswellenlänge von 560 nm (grün-gelber-Bereich) maximal absorbiert. Aufgrund der Isolierung aus P. damicornis werden dieses und strukturell ähnliche Pigmente aus Acropora Arten „Pocilloporine“ genannt.
Es sind zwei Großgruppen von Pocilloporinen zu unterscheiden:
1. Fluoreszierende Pocilloporine
2. Nicht-fluoreszierende, plakativ gefärbte Pocilloporine
2.2.1 Fluoreszierende Pocilloporine
Fluoreszenzfarben von Korallen sehen Aquarianer v.a. während der Blauphase vor dem Einschalten bzw. nach dem Ausschalten der Hauptbeleuchtung (Abb. 6)

Abb. 6
Die für die Fluoreszenz verantwortlichen Pocilloporine absorbieren kurzwellige Strahlung, v.a. zwischen 360 nm (UV-A) – 500 nm (Blau – Grün Bereich), also violette und blaue Strahlungsanteile. Nach Strahlungsabsorption von UV-, Violett – und Blaustrahlung entwickeln sie eine starke Fluoreszenz, die auch oft während der Hauptbeleuchtung sichtbar ist. Unter längerwelligem Licht (500 – 700 nm) erscheinen sie dagegen wenig farbig, weil sie in diesem Spektralbereich nicht absorbieren. Abb. 7
Wissenschaftliche Untersuchungen konnten drei Untergruppen von Pocilloporinen unterscheiden, die alle stark fluoreszieren. Sie sind in Tab. 1. aufgeführt (Daten aus Dove et al. 2001). Dabei richtet sich die Gruppierung nach der jeweils absorbierten Wellenlänge und der entsprechend emittierten Fluoreszenz.
Tab. 1: Vier Typen von wirtsspezifischen Chromoproteinen (Pocilloporinen)
Excitations-Wellenlänge (l) Fluoreszenz-Emission (l)
Gr. 1(F) 360 – 380 nm (UV) 400 – 450 nm (violett) – UV-Schutz?
Gr. 2(F) 420 – 465 nm (violett) 480 – 490 nm (blau)
Gr. 3(F) 480 – 490 nm (blau) 500 – 505 nm (grün)
Gr. 4(N) 550 – 600 nm (grün) 610 – 630 nm (rot) – sehr schwach
F=Fluoreszierendes Pocilloporin, N=Nicht-fluoreszierendes Pocilloporin
Gruppe 1 – Pocilloporine absorbieren UV-A – Strahlung und emittieren eine violette Fluoreszenz. Sie sind im Aquarium eher selten bzw. nur schlecht sichtbar. Die Gruppe 2 – Pocilloporine absorbieren dagegen violette Strahlung und zeigen dann eine blaue Fluoreszenz, die man v.a. während der Blauphase gut wahrnehmen kann. Gruppe 3 – fluoreszierender Pocilloporine absorbieren blaue Strahlung und erzeugen grüne Fluoreszenzen, die in unseren Aquarienkorallen sehr häufig anzutreffen sind und sich mit bestimmten Beleuchtungssystemen sehr gut fördern lassen. In den meisten Fällen findet man in einer Koralle nicht nur einen Typ fluoreszierender Pigmente, sondern es treten durchaus alle drei Gruppen z.B. in einer einzigen Wachstumsspitze nebeneinander auf. Ein Beispiel für zwei der drei genannten Fluoreszenzpigmentgruppen in hermatypischen Steinkorallen zeigt Abb. 7.

Obwohl die Gruppe 1 – Pocilloporine im UV-Bereich absorbieren, diskutiert man sie nicht als UV-Schutzverbindungen, u.a. deshalb nicht, weil die Zooxanthellen eigene UV-Schutzverbindungen synthetisieren und an das Korallengewebe abgeben. Dennoch ist eine UV-Schutzfunktion prinzipiell nicht auszuschließen, in dem kurzwellige und u.U. schädliche UV-A Strahlung in eine längere, energieärmere Strahlung umgewandelt wird. Abb. 8
2.2.2 Nicht-fluoreszierende Pocilloporine (plakative Farben)
Die in Tab. 1 aufgeführte Gruppe 4 enthält solche Pocilloporine, die einerseits erst im langwelligen Grün- und Gelbbereich sichtbarer Strahlung absorbieren und dadurch sehr farbig erscheinen, andererseits aber auch nur sehr schwach rot fluoreszieren. Daher werden sie von den fluoreszierenden Chromoproteinen abgetrennt. Im kurzwelligen Violett – und Blaubereich absorbieren sie Kaum.
Die Farben der nicht-fluoreszierenden Pocilloporine sind überwältigend. Man findet v.a. blaue, grüne, gelbe, pinke und violette Farben. Es sind i.d.R. genau diese Farben, die uns in der Aquarienhaltung in so fern Probleme bereiten, als dass sie oft nur sehr schwer zu erhalten sind, v.a. blaue und gelbe Farben sind hier hervorzuheben.
2.2.3 Funktionen der Pocilloporine
1. Nicht-fluoreszierende Pocilloporine
In der Aquaristikliteratur findet man in den Kapiteln über Licht und Strahlung beinahe immer ein Foto eines bei extremer Tiefstebbe trockengefallenen Riffdachs. Hier sieht man Steinkorallen mit extrem intensiven Farben, v.a. Rot- und Violetttöne sind hier dominierend. Leider findet man im entsprechenden Begleittext regelmäßig die Aussage, es handele sich bei diesen Farbpigmenten um „UV-Schutzverbindungen“. Solche Aussagen sind falsch und müssen schnellstens aus der Literatur verschwinden. Warum es sich dabei nicht um „UV-Schutzpigmente“ handelt, möchte ich wie folgt begründen:
UV-Strahlung ist für das menschliche Auge nicht wahrnehmbar. Da wir diese kurzwelligen Strahlungen nicht sehen, werden sie uns auch nie in einer Farbe erscheinen können. Jedes Molekül, das ausschließlich mit UV-Strahlung wechselwirkt, kann von uns nicht gesehen werden. Die als „UV-Schutzpigmente“ bezeichneten Pocilloporine absorbieren keine UV-Strahlung, sondern sichtbares Licht im Bereich zwischen 500 – 600 nm, und können dadurch von uns Menschen wahrgenommen werden. Weil sie eben keine UV-Strahlung absorbieren, werden sie natürlich auch nicht gegen UV-Strahlung schützen! Wie bereits erwähnt existieren andere UV-Schutzverbindungen in der Koralle – Zooxanthellen – Symbiose, die von den symbiontischen Algen synthetisiert werden und die wir Menschen auch nicht sehen können.
Aber welche Funktionen übernehmen diese Pigmente ? Dazu wurde eine Hypothese aufgestellt (Dove et al. 2001), die im Folgenden stark vereinfacht wiedergegeben wird:
Die nicht-fluoreszierenden Chromoproteine absorbieren in einem Strahlungsbereich, der von den Photosynthesepigmenten (PCP-Komplexe) der Zooxanthellen nicht absorbiert werden kann. Was nicht absorbiert wird, kann eigentlich nicht schaden, so dass man zunächst die Vermutung ausschließen würde, das diese Pigmente die Photosynthese der Zooxanthellen vor Strahlungsschäden bewahren. Allerdings könnte unter extremen Starklichtbedingungen, wie man sie z.B. auf einem Riffdach vorfindet, das Problem bestehen, das Strahlungen zwischen 500 – 600 nm in den Photosystemen der Zooxanthellen gestreut werden. Dieses Streulicht könnte dann aufgrund spezieller physikalischer Wechselwirkungen mit den Chlorophyllen interagieren und dabei die Strahlungsenergie auf die Photosynthesepigmente übertragen. Dies würde zu einer übermäßigen Belastung und damit zu einer Schädigung der Photosynthese führen. Durch die frühzeitige Absorption solcher Wellenlängen (dafür müssen die Pigmente natürlich räumlich oberhalb der Zooxanthellen liegen) wird der Photonendruck, der auf den Zooxanthellen lastet, vermindert. Dies ist die bislang einzige Hypothese zur funktionellen Bedeutung von nicht-fluoreszierenden, stark farbigen Pigmenten.
2. Fluoreszierende Pocilloporine
Prinzip der Absorption und Reemission:
Fluoreszierende Pocilloporine absorbieren kurzwellige Strahlung, z.B. blaue Strahlung bei 500 nm. Sie wandeln die Strahlung dann in eine Fluoreszenz um, was man als Reemission bezeichnet. Die Reemissionsstrahlung ist stets langwelliger (energieärmer) als die ursprünglich absorbierte Strahlung, weil durch die Absorption ein Teil der Strahlungsenergie als Wärme verloren geht.
Die Funktion der fluoreszierenden Pocilloporine richtet sich nun danach, wo diese Chromoproteine in der Koralle lokalisiert sind.
Möglichkeit 1:
Liegen die Pigmente räumlich unterhalb der Zooxanthellen, kann die Fluoreszenz in Richtung der Algen abgestrahlt und von letzteren u.U. photosynthetisch genutzt werden. Dies ermöglicht z.B. der Tiefwasserkoralle Leptoseris fragilis aus dem Roten Meer, noch in über 100 m Wassertiefe zu leben. Die Zooxanthellen in der Koralle liegen oberhalb einer Fluoreszenzpigmentschicht, die UV-A – Strahlung, die von den Zooxanthellen nicht genutzt werden kann, absorbiert und in eine längerwellige blaue Fluoreszenz umwandelt. Die in Richtung der Zooxanthellen ausgestrahlte Fluoreszenz ist für die Dinoflagellaten zur Photosynthese nutzbar, so daß auch in dieser extremen Wassertiefe genügend Strahlung zur Verfügung steht, um Photosynthese zu treiben.
Möglichkeit 2:
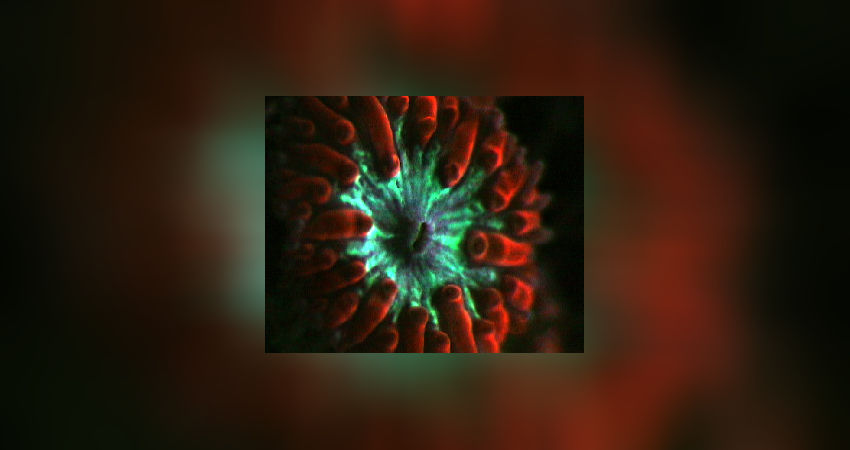
Wenn die Chromoproteine oberhalb der Zooxanthellen lokalisiert sind, dann wird nach Strahlungsabsorption die Fluoreszenz in die Umgebung abgestrahlt und erreicht nicht die Zooxanthellen. Dies kommt einem Schutz der Zooxanthellen vor Strahlungsbelastung unter Starklichtbedingungen gleich. Gerade dies können wir im Aquarium sehr gut beobachten: wir finden in sehr vielen Korallen in den Tentakelspitzen angereicherte Fluoreszenzpigmentkörner (Abb. 8). 
In ihrer Gesamtheit bilden diese Pigmentkörner eine Reflektionsschicht oberhalb der Zooxanthellen. In Abb. 9 ist dies bei Seriatopora caliendrum gezeigt. Dadurch das die Fluoreszenzpigmente in Kristallkörnern vorliegen, reflektieren sie einen Großteil der Strahlung zurück in die Umgebung, was in genannter Abb. 9 die Überbelichtung im Bereich dieser Reflektionsfläche erklärt. Die Zooxanthellen werden dadurch vor zu starker Strahlung geschützt. Abb. 9 Abb. 10

In den meisten großpolypigen Steinkorallen findet man allerdings keine Pigmentkörner, sondern hier sind die Pigmente gleichmäßig im Gewebe verteilt (Abb. 10).
ATI Sun Osram
3. Optimierung der Farbigkeit
Wovon wird die Farbigkeit im Aquarium beeinflußt ?
1) Wahl des Beleuchtungssystems
„Leistung“ des Leuchtmittels
Spektrale Zusammensetzung
2) Nährstoff- und Spurenelementverfügbarkeit
3) Eventuell heterotrophe Ernährung?
3.1 Wahl des Beleuchtungssystems
3.1.1 Anforderungen an Leuchtmittel für die Riffaquaristik:
3.1.1.1 Hohe Strahlungsintensität
Im Gegensatz zu allen bislang in der Riffaquaristik verwendeten Parametern wie z.B. der Bestrahlungsstärke (Einheit: lumen), ist nur die sog. Photonenflußdichte (PFD) für die Riffaquaristik bedeutend, um die Strahlungsintensität zu beurteilen. Die PFD gibt an, welche „Menge“ an photosynthetisch nutzbaren Photonen pro Sekunde auf eine Fläche von 1 m2 trifft (daher Einheit: µmol Photonen/m2/s; statt µmol liest man häufig die ältere Bezeichnung µEinstein (µE)). Unsere Leuchtmittel sollten eine möglichst hohe PFD erzeugen, damit die Korallen und ihre Zooxanthellen mit ausreichend Strahlung versorgt werden. Bei der Messung der PFD werden lediglich die Strahlungen zwischen 400 – 700 nm gemessen, also die photosynthetisch aktive Strahlung, PAR (PAR = photosynthetically active radiation). Dazu verwendet man sog. Quantummeter.
3.1.1 Optimale Anregung der Photosynthesepigmente
Ein riffaquaristisches Leuchtmittel muß die spezielle Pigmentausstattung der Zooxanthellen berücksichtigen (PCP-Komplexe). Daher sollten im Emissionsspektrum des Leuchtmittels folgende Strahlungen ausreichend vorhanden sein:
430 m (Chlorophyll a)
440-470 nm (PCP-Komplexe)
630 nm (Chlorophyll c2), 660 nm (Chl a)
3.1.2 Gute Farbwiedergabe
Bestehende Farben können nur dann optimal zur Geltung kommen, wenn die farberzeugenden Pigmente mit der richtigen Strahlung angeregt werden. Daher sollten Leuchtmittel mit einem möglichst ausgeglichenen Emissionsspektrum zum Einsatz kommen, was sich in einem hohen Farbwiedergabeindex widerspiegelt. Bei Verwendung eines Leuchtmittels mit vielen „Lücken“ im Spektrum erhöht sich die Wahrscheinlichkeit, das eine bestehende Farben schlecht sichtbar ist.
3.1.3 Möglichst geringe UV-Emission < 380 nm
UV-Strahlung wird im Allgemeinen als sehr schädlich diskutiert. Unter einer UV-Bestrahlung werden die Zooxanthellen die bereits erwähnten UV-Schutzverbindungen unter hohem Energieaufwand produzieren. Diese Synthese geht auf Kosten des Wachstums von Korallen. Schlecht wachsende Korallen können v.a. in instabilen Aquarium sehr schnell dem Konkurrenzdruck von Algen unterliegen. Eine Ausbreitung von Algen oder Cyanobakterien ist daher möglich. Da bereits verdeutlicht wurde, das die Farbigkeit von Steinkorallen mit UV-Strahlung nichts zu tun hat, ist eine zusätzliche UV-Bestrahlung nicht nur unsinnig, sondern auch gefährlich. UV-Strahlung schädigt auch die Augen von Fischen und natürlich auch des Aquarianers !
Alle diese Anforderungen kann ein einziges Leuchtmittel i.d.R. nicht erfüllen. Daher ist eine Kombination mehrerer verschiedener Leuchtmittel zu empfehlen, z.B.
Leuchtmittel 1: optimiert für Photosynthese
Leuchtmittel 2: optimiert für Farbpigmentpildung
Bei der Verwendung mehrerer Leuchtmittel gilt: Das Gesamtemissionsspektrum entspricht stets der Summe aller Einzelspektren.
3.1.2 Wie interpretiert man Emissionsspektren von Leuchtmitteln ?
Von beinahe allen aquaristischen Leuchtmitteln, seien es HQI-Brenner oder Leuchtstoffröhren, werden von den Herstellern bzw. den Vertreibern die Emissionsspektren angeboten (z.B. auf der Verpackung, oder auf der entsprechenden Homepage im Internet). Um die Frage zu erleichtern, welches Leuchtmittel für die individuellen Bedürfnisse optimal ist, kann es hilfreich sein, wenn man dazu in der Lage ist, diese Spektren zu interpretieren.
Ein Emissionsspektrum ist i.d.R. immer gleich aufgebaut. Auf der x-Achse liest man die Strahlungswellenlänge (Einheit nano Meter, nm) ab, auf der y-Achse i.d.R. die sog. relative Intensität in %. Jedes Leuchtmittel emittiert bestimmte Strahlungsanteile sehr stark, andere Wellenlängen dagegen weniger. Meist sieht man steil nach oben ragende Emissionspeaks, die zeigen, dass im Bereich dieser Wellenlänge viel Strahlung emittiert wird. Der höchste Emissionspeak wird dabei in der Regel mit 100% Intensität bewertet. Alle übrigen Emissionen richten sich dann nach diesem Peak, z.B. 50% der maximalen (100%) Emission, so daß wir von einer relativen oder normalisierten Intensität sprechen. Diese Prozentangaben geben natürlich keine Idee darüber, wie viel Strahlung tatsächlich ausgestrahlt wird, d.h. ob die Strahlungsintensität hoch oder niedrig ist.
Im folgenden sollen Emissionsspektren verschiedener Beleuchtungsmittel diskutiert werden. Dabei können aus Gründen des Copyrights die jeweiligen Spektren nur mit Angabe der Quellen angegeben werden bzw. es finden sich entsprechende Links zu den Internetseiten, auf denen die Spektren veröffentlicht sind.
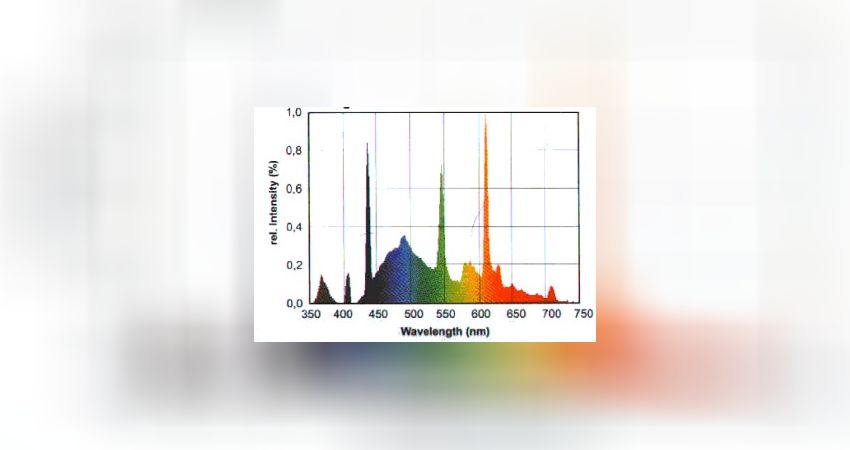
„10000 K“ HQI - Brenner
· Typischerweise hoher Anteil violetter Strahlung zwischen 380 – 450 nm. Dieser Wellenlängenbereich ist photosynthetisch nicht gut nutzbar.
· Wenig Strahlungsemission im Blaubereich zwischen 450 – 500 nm. Dieser Bereich ist für die Photosynthese wichtig, wird allerdings nur schwach emittiert, weshalb eine zusätzliche Blaubeleuchtung zu empfehlen ist.
· Der Ausgleich der Violettlastigkeit erfolgt über einen hohen Emissionspeak im Grünbereich zwischen 500 und 600 nm, oft zwischen 530 und 560 nm. Manche Brenner wirken daher leicht grün.
· Wenig Strahlungsemission im übrigen Grün-, Gelb- und Rotbereich, weshalb die Farbwiedergabe i.d.R. eher „mäßig“ ist.
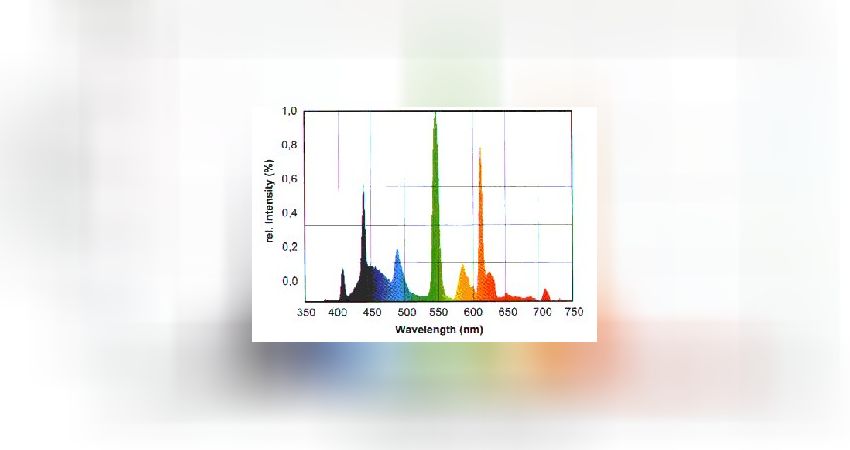
Daylight-Brenner (HQI-D – Brenner) (6000 – 6500 K)
· Geringer Violett- und Blauanteil: Dieser Bereich ist für die Photosynthese sehr wichtig und muß durch eine zusätzliche Blaubeleuchtung ersetzt werden.
· Strahlungsemission v.a. im grünen- und gelben Spektralbereich , daher sind diese Brenner oft „gelbstichig“.
· Rote Strahlungsanteile sind vorhanden und fördern hier v.a. auch die Photosynthese (Chlorophyllabsorption bei 640 – 660 nm)
· Farbwiedergabe ist oft sehr gut.
Wichtiger Hinweis zum Thema Farbtemperatur:
Die Farbtemperatur eines Leuchtmittels ist alles andere als ein guter Parameter, um die Qualität eines Leuchtmittels zu beurteilen! Von daher sollten den Kelvinangaben in Zukunft weniger Relevanz zugeschrieben werden. Wie das Beispiel der beiden HQI-D – Brenner bei Joshi & Morgan (1999) zeigt, läßt sich mehr oder weniger die gleiche Farbtemperatur mit zwei völlig verschiedenen Emissionsspektren erzeugen. Die Qualität eines Leuchtmittels hängt (abgesehen von Farbstabilität, Preis-Leistungsverhältnis) von der spektralen Zusammensetzung ab, nicht von der Farbtemperatur! Es darf also nicht behauptet werden, das bezüglich der Farbigkeit von Korallen ein Brenner mit Farbtemperatur x besser ist als ein Brenner mit Farbtemperatur y.
„20000“ K – Brenner
· Hoher Emissionspeak im Blaubereich bei 450 nm
· Absorptionsmaximum von Chl a/c2 und der PCP-Komplexe wird nicht richtig getroffen.
· Photosynthetische Nutzbarkeit fraglich, reine Zusatzbeleuchtung, aber:
· Blauröhren sind zu bevorzugen, da hier ein breiteres Blauspektrum mit besserer photosynthetischer Nutzbarkeit emittiert wird.
· Schlechteste Farbwiedergabe aller Leuchtmittel (weil außer bei 450 nm keine Strahlung emittiert wird!)
Vollspektrumröhren
· Ausgeglichene Spektren mit Anteilen im blauen-, grünen-, gelben- und roten Spektralbereich
· Bester Kompromiß zwischen photosynthetischer Nutzbarkeit und guter Farbwiedergabe
· Blauzusatz ist dennoch zu empfehlen, um die Photosynthese zu fördern.
Blue
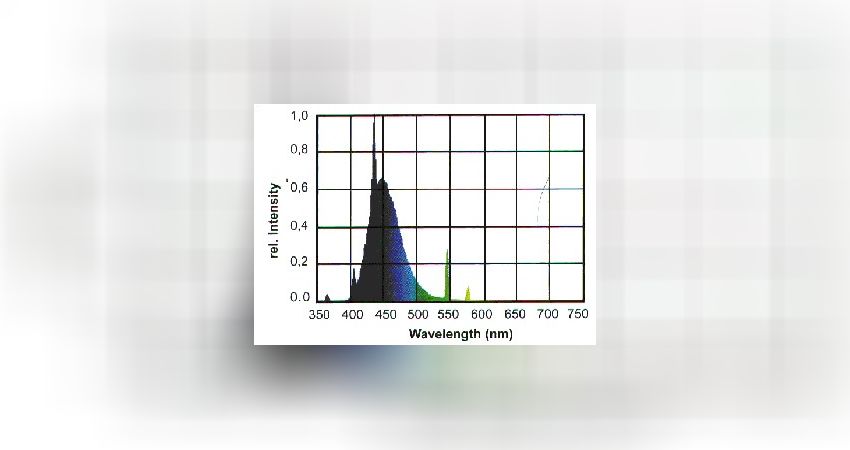
Blauröhren
· Reine Zusatzbeleuchtung zur Optimierung der photosynthetischen Nutzbarkeit des Gesamtspektrums
· Achtung UV-Anteil: UV-Strahlung setzt Wachstumsraten herab, daher möglichst geringe UV-Emission
· Ideal zur Förderung von Fluoreszenzpigmenten
· Schlechte Farbwiedergabe, da nur Violett- und Blaustrahlung emittiert wird.
3.1.3 Welche Beleuchtung ist optimal ? Abb. 11
Die zentrale Frage, die sich Aquarianer oft stellen, lautet:
„Welches Beleuchtungssystem ist das Beste für die Farbpigmentierung der Korallen ?“
Stellt man die Frage genau so, wird kein Mensch darauf eine Antwort geben können. Die Frage muß anders formuliert werden:
„Mit welcher Beleuchtung können die gewünschten Farben optimal gebildet und wiedergegeben werden ?“
Hier ist der Aspekt der Beeinflußbarkeit der Farbigkeit von Korallen mit einbezogen, aber: prinzipiell müssen wir uns entscheiden, ob wir
A) die Fluoreszenzfarben optimal fördern, oder
B) die plakativen Farben in Steinkorallen optimal „herausarbeiten“ wollen.
Es wird uns nie gelingen, beide „Farben“ gleichzeitig unter einer Beleuchtungseinheit optimal zu fördern. Selbst wenn die Pigmente in den Korallen vorhanden sind, ist immer noch die Frage offen, ob sich die verwendete Beleuchtung dazu eignet, diese Farben sichtbar zu machen (Stichwort Farbwiedergabe). Letztlich werden Pigmente nur dann synthetisiert, wenn sie mit der richtigen Strahlung angeregt werden. Fehlt diese Strahlung im Emissionsspektrum der Leuchten, so wird dieses Pigment nicht gut gebildet werden. Auch muß man immer im Hinterkopf behalten, das nicht jede Koralle ein Pigment synthetisieren kann, weil die entsprechende genetische Information fehlt. Manche Korallen sind braun und bleiben auch braun, unabhängig von der verwendeten Beleuchtung!
Zu Punkt A: Optimierung von Fluoreszenzfarben
1. Induktion der Synthese durch kurzwellige Violett- und Blaustrahlung
Dazu eignen sich z.B.
1. Blauröhren
2. 10000 K und 14000 K HQI-Brenner
· Förderung i.d.R. unabhängig von der Strahlungsintensität
Zu Punkt B: Optimierung der plakativen Farben
· Die Pigmente absorbieren zwischen 500 – 600 nm, daher Induktion der Synthese nach Anregung mit diesen Wellenlängen
· Dazu eignen sich Leuchtmittel mit ausgeglichenen Spektren und entsprechend sehr guter Farbwiedergabe, z.B.
1. Vollspektrumröhren (ausgeglichenes Spektrum)
2. HQI-D – Brenner (hoher Anteil an Strahlung zwischen 500 – 600 nm, Kombination mit Blauröhren wichtig !)
· Die für die plakativen Farben verantwortlichen Nicht-fluoreszierenden Pocilloporine haben wahrscheinlich Schutzfunktion unter Starklichtbedingungen, daher sind i.d.R. leistungsstarke Leuchtmittel mit guten Reflektoren zu verwenden.
3.2 Nährstoff- und Spurenelementverfügbarkeit
3.2.1 Spurenelemente
Regelmäßige Spurenelement-Dosierungen sind wichtig, da z.B. Eisen-, Mangan oder Molybdän als Bestandteile wichtiger Enzyme wachstumslimitierend sind. Allerdings ist es sehr wichtig, die Spurenelementgaben dem vorliegenden Nährstoffgehalt anzupassen.
Je höher der Nährstoffgehalt (z.B. Nitrat- und Phosphatgehalt) im Becken ist, desto höher wird auch der Spurenelementbedarf der Algen, Korallen- und Zooxanthellen sein. V.a. Eisen spielt hier eine wichtige Rolle, da es nach Stickstoff und Phosphor das in den Organismen häufigste Nährelement ist. Wenn also ausreichend Stickstoff und Phosphat im Wasser vorhanden ist, wird sehr schnell der Eisengehalt sinken und dieses wichtige Nährelement fehlen.
Sind dagegen die Nährstoffe sehr niedrig oder mit den herkömmlichen Tropftest nicht mehr nachweisbar, kann eine Spurenelementüberdosierung bereits toxische Folgen haben oder auch das Wachstum von unerwünschten Algen oder Cyanobakterien fördern.
3.2.2 Nährstoffgehalt
Es sind bezüglich der Farbigkeit von Steinkorallen möglichst niedrige Nährstoffgehalte (v.a. Stickstoff, Phosphor) anzustreben. Ein hoher Nährstoffgehalt wird sich meist in einer Erhöhung der Zooxanthellendichte im Korallengewebe äußern. Anders herum wird die Zooxanthellendichte abnehmen, wenn der Nährstoffgehalt sinkt.
Je niedriger die Zooxanthellendichte ist, desto heller wird das Korallengewebe und desto besser werden nur gering vorhandene Farbpigmente in den Korallen zur Geltung kommen (Bsp. Abb. 11)

Je höher die Zooxanthellendichte, desto brauner (dunkler) wird die Koralle und vorhandene Farbpigmente werden schnell überlagert.
Wie hängt der externe Nährstoffgehalt in der Wassersäule mit der Zooxanthellendichte zusammen ?
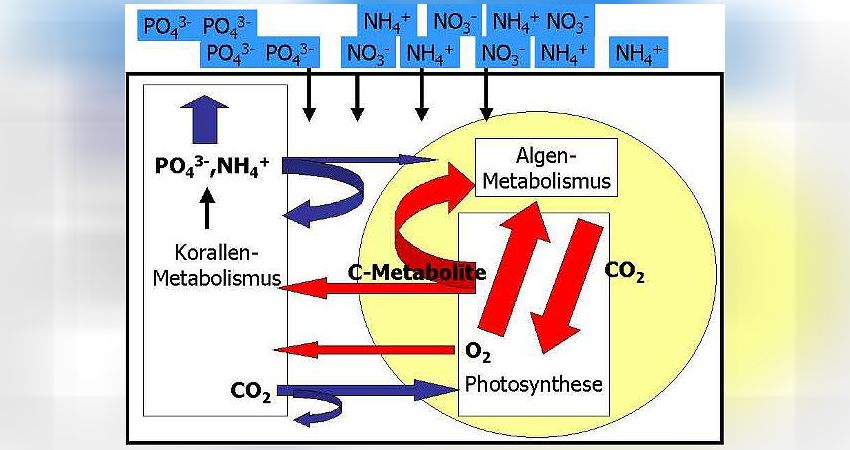
Beispiel niedrige Nährstoffgehalte = geringe Zooxanthellendichte (vgl. Abb. 12)

Durch Diffusion gelangen die wenigen im Meerwasser vorhandenen Nährstoffe in die Korallenzellen. Die Zooxanthellen im Korallengewebe treiben, angetrieben durch die Sonnenstrahlung, Photosynthese und nutzen dabei die Strahlungsenergie, um energiereiche Kohlenstoffmetabolite (C-Metabolite) wie Zucker, Fettsäuren oder Aminosäuren selbst herzustellen. Typischerweise geben die Zooxanthellen einen Großteil dieser C-Metabolite an die Koralle ab, so daß diese mit energiereicher Nahrung versorgt ist. Natürlich werden die Zooxanthellen auch einen Teil dieser Zucker für den eigenen Stoffwechsel verbrauchen. Die Photosynthese erzeugt darüber hinaus Sauerstoff, O2, als Abfallprodukt. Der Sauerstoff wird ebenfalls der Koralle zur Verfügung gestellt, damit letztere die C-Metabolite verbrennen kann (wodurch die Koralle ihre Energie bezieht). Wiederum benötigen die Zooxanthellen einen Teil des produzierten Sauerstoffes zur Verbrennung der eigenen C-Metabolite.
Aus der Verbrennung von energiereichen C-Metaboliten resultiert Kohlendioxid, CO2. Kohlendioxid ist wichtiger Baustein für die in der Photosynthese produzierten C-Metabolite. Die Zooxanthellen erzeugen durch ihren eigenen Stoffwechsel nicht genügend CO2, um damit die Photosynthese optimal anzutreiben. Deshalb wird die Koralle das frei werdende CO2 aus ihrem Stoffwechsel den Zooxanthellen zur Verfügung stellen. Dieser Effekt ist bei kalkabscheidenden Steinkorallen von großer Wichtigkeit: Freies CO2 in den Korallenzellen hindert die Calcifizierung, also die Skelettbildung. Das zooxanthellate Steinkorallen gegenüber den azooxanthellaten Steinkorallen (z.B. Tubastrea Arten) so hohe Wachstumsraten zeigen, liegt v.a. daran, das die Zooxanthellen in den hermatypischen Steinkorallen das Kohlendioxid ständig entfernen!
Die aus dem Korallenstoffwechsel resultierenden Nährstoffe Phosphat und Ammonium werden die Korallen den Zooxanthellen ebenfalls abgeben, um die Algen mit diesen wichtigen Nährstoffen zu versorgen, die in der Wassersäule fehlen (Nährstoffmangel). Dennoch ist das Angebot an Ammonium und Phosphat zu gering, als das sich die Zooxanthellen stark vermehren könnten. Entsprechend ist der eigene Bedarf an C-Metaboliten für die Zooxanthellen nicht so hoch und sie können diese hauptsächlich den Korallen abgeben. Dadurch wird das Wachstum der Korallen gefördert.
Beispiel hohe Nährstoffgehalte = hohe Zooxanthellendichte (vgl. Abb. 13)
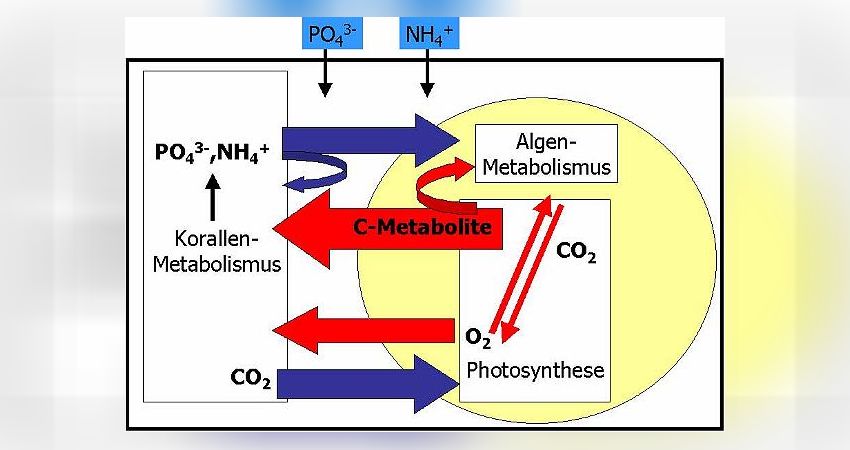
Im Vergleich zur Abb. 12 ist das Schema identisch, nur das der externe Nährstoffgehalt im Wasser sehr hoch ist. Unter diesen Bedingungen werden durch Diffusion sehr viele der Nährstoffe in die Korallenzellen gelangen und die Zooxanthellen dadurch sehr stark gedüngt. Sie können jetzt, im Vergleich zur Situation mit niedrigen Nährstoffgehalten, wachsen und sich v.a. durch Zellteilung schnell vermehren. Dies ist von den Korallen nicht kontrollierbar und die Zooxanthellendichte steigt im Gewebe an: die Koralle wird braun.
Welche Konsequenzen hat diese starke Vermehrung der Zooxanthellen ? Durch Wachstum und Teilung müssen Zellbestandteile von den Zooxanthellen neu hergestellt werden. Das kostet Energie. Entsprechend können die Zooxanthellen nur noch einen geringen Teil der C-Metabolite zur Koralle abgeben, den überwiegenden Teil müssen sie selbst verbrennen. Zur Verbrennung verwenden sie den aus der Photosynthese stammenden Sauerstoff, so daß auch dieser nicht mehr ausreichend für die Koralle zur Verfügung steht. Die Koralle wird also beginnen zu hungern und hat möglicherweise auch ein Defizit an Sauerstoff.
Wenn die Zooxanthellen ihre C-Metabolite mit dem Sauerstoff verbrennen, produzieren sie genügend Kohlendioxid, um damit die Photosynthese eigenständig und ohne die CO2-Zusatzversorgung der Korallen anzutreiben. Das CO2, das die Korallen selbst produzieren, verbleibt also in den Korallenzellen und hier kommt es nun zur Hemmung der Calcifizierung, so daß eine Abnahme der Skelettbildungsrate die Folge ist.
Zusammenfassung:
· Durch die übermäßige Stickstoff- und Phosphordüngung vermehren sich die Zooxanthellen
· Dadurch steigt die Zooxanthellendichte an (keine Kontrolle mehr durch die Koralle)
· Die Algen verbrennen ihre eigenen C-Metabolite, entsprechend „hungert“ die Koralle
· Freie CO2 hemmt die Skelettbildung
· Folge: Abnahme in der Wachstumsrate und weniger Energie für Farbpigmentbildung!
3.3 Heterotrophe Ernährung
Der Anteil der heterotrophen Ernährung bei zooxanthellaten Korallen in der Natur kann mit 10-50% des Gesamt-Kohlenstoff sehr hoch sein. Eine zusätzliche Ernährung unserer Aquarienkorallen mit lebendem Phytoplankton und lebendem Zooplankton (z.B. Copepoden) kann daher sehr förderlich sein.
Über diese externe Nahrungsaufnahme könnten auch Substanzen aufgenommen werden, die für die Farbpigmentbildung u.U. wichtig sind.
4. Zusammenfassung
· Die Farben in hermatypischen Steinkorallen gehen auf Chromoproteine zurück, die man Pocilloporine nennt.
· Man unterscheidet fluoreszierende Pocilloporine von nicht-fluoreszierenden Pocilloporinen
· Die farbigen nicht-fluoreszierenden Pocilloporine bieten keinen Schutz vor UV-Strahlung!
· Die Bildung der Chromoproteine hängt im Aquarium primär von der Beleuchtungsqualität ab (v.a. Emissionsspektrum)
· Fluoreszenzfarben können mit kurzwelliger Strahlung gefördert werden (Blaustrahlung)
· Förderung plakativer Farben mit Strahlung zwischen 500 – 600 nm (hohe Intensität)
· Optimale Wasserwerte, geringe Nährstoffgehalte und daran angepaßte Spurenelementversorgung
· Zusätzliche Fütterung mit Phyto- und Zooplankton
Literatur:
Brockmann, D. (2002): Ein Riffdach im Aquarium. 2. 36(8): 37-45.
Dove, S. Dove, S. G., Hoegh-Guldberg, O. & Ranganathan, S. (2001): Major colour patterns of reef-building corals are due to a family of GFP-like proteins. Coral Reefs 19: 197-204.
Ferrier-Pagès, C., Gattuso, J-P., Dallot, S. & Jaubert, J. (2000): Effect of nutrient enrichment on growth and photosynthesis of the zooxanthellate coral Stylophora pistillata. Coral Reefs 19: 103-13.
Joshi, S. & Morgan, D, (1999): Spectral analysis of metal halide lamps used In the reef hobby. 2. Aquarium Frontiers Magazine, January 1999.
http://www.animalnetwork.com/fish2/aqfm/1999/jan/features/2/default.asp
Fotos und Text: (c) Jörg Kokott
Wie gefällt Ihnen dieser Artikel?
Infos
Autor

Lesezeichen
Kommentare
Themen
Ähnliche Artikel
- Xtremelight LeduX - Die neue LED
- Korallen und ihre Farben
- Produktvorstellung: Das ist die REEFLIGHT LED 2019
- News: Die neue REEF FLARE PRO von Reef Factory
- HQI contra T5
- News: daytime® LED-System onex®
- 10 Teil: Langzeittest T5 Röhren - Der Abschluss
- Vermehrungsstrategien von Pilzkorallen - Fungia sp.
- LEDURON Aquatic Light
- Wie ein Meerwasseraquarium entsteht Teil 38: Wenn Korallen sich vernesseln, Kampf um Siedlungsraum
Kommentare Zum Anfang
Bitte anmelden
Damit Sie selbst etwas schreiben können, müssen Sie sich vorher anmelden.






